Joseph-Louis Gay-Lussac ialah
kimiawan dan fisikawan Perancis. Ia terkenal untuk 2 hukum yang
berkenaan pada gas. Selain itu Ia juga terkenal untuk karyanya pada
campuran alk0h0l-air, derajat Gay-Lussac itu digunakan untuk mengukur
minuman beralk0h0l di banyak negara. Ia juga merupakan penemu boron.
Biografi
Gay-Lussac lahir pada 6 Desember 1778 di St Leonard dari Noblac, di bagian Haute-Vienne. Ayahnya, Anthony Gay, anak seorang dokter, ia adalah seorang pengacara dan jaksa, bekerja sebagai hakim di Noblat Bridge. Anthony Gay memiliki dua putra dan tiga putri.
Ia menerima pendidikan awal di biara Katolik Bourdeix. Kemudian, dalam perawatan Abbot dari Dumonteil ia mulai pendidikan di Paris, akhirnya memasuki École Polytechnique pada tahun 1798. Gay-Lussac nyaris masuk wajib militer dan pada saat masuk ke École Polytechnique ayahnya telah ditangkap (karena Robespierre 's Reign of Terror). Tiga tahun kemudian, Gay-Lussac ditransfer ke École des Ponts et Chaussées , dan tak lama kemudian ditugaskan untuk CL Berthollet sebagai asistennya. Pada tahun 1802, ia diangkat demonstran ke AF Fourcroy di École Polytechnique, di mana di (1809) ia menjadi profesor kimia. Dari 1808-1832, ia adalah profesor fisika di Sorbonne. Pada tahun 1821, ia terpilih sebagai anggota asing dari Royal Swedish Academy of Sciences. Pada 1831 ia terpilih untuk mewakili Haute-Vienne di ruang deputi, dan pada tahun 1839 ia memasuki ruang dari rekan-rekan.
Pada tahun 1809 Gay-Lussac menikah dengah Geneviève-Marie-Joseph Rojot. Ia pertama kali bertemu ketika dia bekerja sebagai asisten toko linen draper dan sedang belajar buku teks kimia di bawah meja. Dia ayah lima anak, di antaranya yang tertua (Jules) menjadi asisten Justus Liebig di Giessen.
Gay-Lussac meninggal di Paris, dan makamnya di Père Lachaise Cemetery, Paris. Namanya adalah salah satu dari 72 nama yang tertulis di Menara Eiffel .
Di Paris sebuah jalan dan hotel dekat Sorbonne dinamai menurut namanya seperti lapangan di tempat kelahirannya, St Leonard dari Noblac.
Hukum Gay-Lussac
Hukum Gay-Lussac dapat merujuk kepada salah satu dari dua hukum kimia yang dikemukakan oleh Joseph Louis Gay-Lussac yang berhubungan dengan sifat-sifat gas.
Hukum Gay-Lussac 1802
Pada 1802, Gay-Lussac menemukan bahwa, Tekanan dari sejumlah tetap gas pada volum yang tetap berbanding lurus dengan temperaturnya dalam kelvin.
Secara matematis dapat dinyatakan
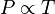
atau
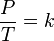
dimana: P adalah tekanan gas. T adalah temperatur gas (dalam Kelvin). dan k adalah sebuah konstanta.
Hukum ini dapat dibuktikan melalui teori kinetik gas, karena temperatur adalah ukuran rata-rata energi kinetik, dimana jika energi kinetik gas meningkat, maka partikel-partikel gas akan bertumbukan dengan dinding/wadah lebih cepat, sehingga meningkatkan tekanan.
Hukum Gay-Lussac dapat dituliskan sebagai perbandingan dua gas

Hukum Gay-Lussac 1809
Hukum ini disebut juga hukum gabungan volum, yang ditemukan pada 1809
Perbandingan volum antara gas-gas dalam suatu reaksi kimia adalah perbandingan bilangan bulat sederhana
Misalnya perbandingan volum hidrogen dan oksigen yang dihasilkan dari penguraian air adalah 2:1. Hukum ini merupakan salah satu dasar dari stoikiometri gas modern, dan hipotesis Avogadro pada 1811 berasal dari hukum ini.
Hukum Charles
Hukum Charles juga kadang-kadang disebut Hukum Gay-Lussac atau Hukum CharlesGay-Lussac, karena Gay-Lussac lah yang pertama kali mempublikasikan penemuan ini pada 1802. Jacques Charles telah menemukannya lebih dahulu pada 1787, namun tidak mempublikasikannya.Belakangan hukum ini lebih sering disebut hukum Charleskarena kemudian Gay-Lussac menemukan hukum-hukum lain yang dinamakan sesuai namanya.
Dalam termodinamika dan kimia fisik, hukum Charles adalah hukum gas ideal pada tekanan tetap yang menyatakan bahwa
pada tekanan tetap, volume gas ideal bermassa tertentu berbanding lurus terhadap temperaturnya (dalam Kelvin).
Secara matematis, hukum Charles dapat ditulis sebagai:
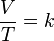
dengan: V: volume gas (m3), T: temperatur gas (K), dan k: konstanta.
Biografi
Gay-Lussac lahir pada 6 Desember 1778 di St Leonard dari Noblac, di bagian Haute-Vienne. Ayahnya, Anthony Gay, anak seorang dokter, ia adalah seorang pengacara dan jaksa, bekerja sebagai hakim di Noblat Bridge. Anthony Gay memiliki dua putra dan tiga putri.
Ia menerima pendidikan awal di biara Katolik Bourdeix. Kemudian, dalam perawatan Abbot dari Dumonteil ia mulai pendidikan di Paris, akhirnya memasuki École Polytechnique pada tahun 1798. Gay-Lussac nyaris masuk wajib militer dan pada saat masuk ke École Polytechnique ayahnya telah ditangkap (karena Robespierre 's Reign of Terror). Tiga tahun kemudian, Gay-Lussac ditransfer ke École des Ponts et Chaussées , dan tak lama kemudian ditugaskan untuk CL Berthollet sebagai asistennya. Pada tahun 1802, ia diangkat demonstran ke AF Fourcroy di École Polytechnique, di mana di (1809) ia menjadi profesor kimia. Dari 1808-1832, ia adalah profesor fisika di Sorbonne. Pada tahun 1821, ia terpilih sebagai anggota asing dari Royal Swedish Academy of Sciences. Pada 1831 ia terpilih untuk mewakili Haute-Vienne di ruang deputi, dan pada tahun 1839 ia memasuki ruang dari rekan-rekan.
Pada tahun 1809 Gay-Lussac menikah dengah Geneviève-Marie-Joseph Rojot. Ia pertama kali bertemu ketika dia bekerja sebagai asisten toko linen draper dan sedang belajar buku teks kimia di bawah meja. Dia ayah lima anak, di antaranya yang tertua (Jules) menjadi asisten Justus Liebig di Giessen.
Gay-Lussac meninggal di Paris, dan makamnya di Père Lachaise Cemetery, Paris. Namanya adalah salah satu dari 72 nama yang tertulis di Menara Eiffel .
Di Paris sebuah jalan dan hotel dekat Sorbonne dinamai menurut namanya seperti lapangan di tempat kelahirannya, St Leonard dari Noblac.
Hukum Gay-Lussac
Hukum Gay-Lussac dapat merujuk kepada salah satu dari dua hukum kimia yang dikemukakan oleh Joseph Louis Gay-Lussac yang berhubungan dengan sifat-sifat gas.
Hukum Gay-Lussac 1802
Pada 1802, Gay-Lussac menemukan bahwa, Tekanan dari sejumlah tetap gas pada volum yang tetap berbanding lurus dengan temperaturnya dalam kelvin.
Secara matematis dapat dinyatakan
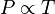
atau
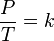
dimana: P adalah tekanan gas. T adalah temperatur gas (dalam Kelvin). dan k adalah sebuah konstanta.
Hukum ini dapat dibuktikan melalui teori kinetik gas, karena temperatur adalah ukuran rata-rata energi kinetik, dimana jika energi kinetik gas meningkat, maka partikel-partikel gas akan bertumbukan dengan dinding/wadah lebih cepat, sehingga meningkatkan tekanan.
Hukum Gay-Lussac dapat dituliskan sebagai perbandingan dua gas

Hukum Gay-Lussac 1809
Hukum ini disebut juga hukum gabungan volum, yang ditemukan pada 1809
Perbandingan volum antara gas-gas dalam suatu reaksi kimia adalah perbandingan bilangan bulat sederhana
Misalnya perbandingan volum hidrogen dan oksigen yang dihasilkan dari penguraian air adalah 2:1. Hukum ini merupakan salah satu dasar dari stoikiometri gas modern, dan hipotesis Avogadro pada 1811 berasal dari hukum ini.
Hukum Charles
Hukum Charles juga kadang-kadang disebut Hukum Gay-Lussac atau Hukum CharlesGay-Lussac, karena Gay-Lussac lah yang pertama kali mempublikasikan penemuan ini pada 1802. Jacques Charles telah menemukannya lebih dahulu pada 1787, namun tidak mempublikasikannya.Belakangan hukum ini lebih sering disebut hukum Charleskarena kemudian Gay-Lussac menemukan hukum-hukum lain yang dinamakan sesuai namanya.
Dalam termodinamika dan kimia fisik, hukum Charles adalah hukum gas ideal pada tekanan tetap yang menyatakan bahwa
pada tekanan tetap, volume gas ideal bermassa tertentu berbanding lurus terhadap temperaturnya (dalam Kelvin).
Secara matematis, hukum Charles dapat ditulis sebagai:
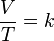
dengan: V: volume gas (m3), T: temperatur gas (K), dan k: konstanta.


 16.32
16.32
 Unknown
Unknown


0 komentar :
Posting Komentar